Rumus Fraksi Mol Beserta Contoh Soalnya Lengkap
Fraksi Mol – Fraksi mol adalah ukuran konsentrasi larutan yang menyatakan adanya perbandingan, pada jumlah mol dengan sebagian zat pada jumlah mol total komponen larutan.

Fraksi mol ini sering disebut dengan fraksi jumlah dan selalu identik dengan fraksi angka, yang digambarkan sebagai jumlah molekul suatu konsisten dibanding dengan jumlah total seluruh molekul. Konsep ini hanya menjadi salah satu cara yang menunjukkan adanya komposisi campuran, dengan satuan yang tidak memiliki dimensi. Fraksi mol ini terkadang dilambangkan dengan huruf Yunani daripada abjad Romawi.
Dalam hitungan ilmu kimia jumlah banyak zat terlarut di dalam pelarut, yang disebut dengan konsentrasi. Konsentrasi larutan perlu dihitung dengan cara yang tepat, yaitu dengan cara menentukan massa zat terlarut dan juga pelarut.
Konsentrasi larutan ini berupa molalitas, fraksi mol, dan juga persen massa. Yang dimana hal itu dijelaskan dalam rumusnya masing-masing.
Rumus Fraksi Mol
Molalitas merupakan konsentrasi larutan yang menyatakan jumlah mol, yaitu zat terlarut dalam 1 Kg atau 1000 Gr pelarut. Rumusnya adalah :
Jumlah mol zat pelarut / 1Kg zat pelarut
Fraksi mol yang terlarut (Xt) dapat dirumuskan dengan rumus sebagai berikut :
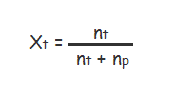
Keterangan :
- Xt : Fraksi mol zat terlarut
- Np : Jumlah mol zat pelarut
- Nt : Jumlah mol zat terlarut
Fraksi mol zat pelarut (Xp) biasanya dirumuskan dengan rumus berikut :

Hubungan antara Molalitas dengan Persen massa
Persen massa adalah satuan konsentrasi yang juga bisa digunakan dalam larutan kimia. Misalnya yaitu larutan yang biasa kita temui dalam kehidupan sehari-hari yaitu larutan alkohol sebanyak 75% dan larutan asam cuka sebanyak 24%. Persen massa merupakan jumlah gram zat yang terlarut dalam 100 Gr massa larutan.
Persamaan yang menunjukkan perhitungan persen massa adalah sebagai berikut :
![]()
Hubungan antara Molalitas dengan Molaritas
Molaritas menyakan sejumlah zat yang sudah terlarut dalam satu liter larutan. Molaritas juga dapat dikonversikan menjadi molalitas, caranya yaitu dengan merubah volume larutan menjadi massa larutan. Pengubahan volume menjadi massa ini dibutuhkan data massa jenis larutan yang bisa dirumuskan seperti berikut :
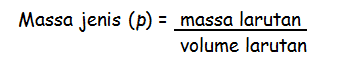
Normalitas adalah besaran yang menyatakan jumlah mol ekivalen dengan zat yang terlarut dalam setiap satuan volume larutan. Satuan normalitas adalah normal (N) yang sama dengan mol ekivalen/liter. Normalitas juga memiliki rumus berikut :
N = ek/V atau N= n.a/V atau bisa juga N = M x a
Keterangan :
Ek adalah mol ekivalen yakni jumlah mol dikalikan dengan jumlah ion H+ atau ion OH-
Sifat Koligatif Larutan
Walaupun sifat koligatif selalu melibatkan beberapa larutan, tetapi sifat koligatif ini tidak bergantung pada interaksi antara zat pelarut dengan molekul pelarut, tapi bergantung pada jumlah zat pelarut yang larut di suatu larutan. Sifat koligatif ini terdiri atas penurunan uap dan kenaikan titik didih serta penurunan titik beku, dan juga tekanan osmotik.
Molekul zat cair yang meninggalkan permukaan menyebabkan adanya tekanan uap zat cair. Semakin mudahnya molekul zat zair itu berubah menjadi uap, maka semakin tinggi juga tekanan pada zat uap cair tersebut. tetapi jika tekanan zat cair itu dilarutkan pada zat terlarut yang tak menguap, maka partikel zat yang terlarut akan mengurangi penguapan pada molekul zat cair. Laut mati adalah contoh dari peristiwa penurunan tekanan uap pelarut oleh zat yang terlarut yang tak mudah menguap.
Contoh Soal Fraksi Mol
Sebuah larutan terdiri dari 3 mol zat A, 3 mol zat B, dan 4 mol zat C. Hitung fraksi mol dari masing – masing zat tersebut ?
Pembahasan :
Diketahui :
nA = 3
nB = 3
nC = 4
Penyelesaian :
XA = nA / (nA + nB +nC)
XA = 3 / (3 + 3 + 4)
XA = 0.3
XA = nA / (nA + nB +nC)
XA = 3 / (3 + 3 + 4)
XA = 0.3
XA = nA / (nA + nB +nC)
XA = 4 / (3 + 3 + 4)
XA = 0.4
Jadi total dari XA + XB + XC = 0.3 + 0.3 + 0.4 = 1
Sekian pembahasan materi fraksi mol yang lengkap, mulai dari pengertian sampai contoh soalnya. Semoga memberi manfaat bagi anda semua dan memudahkan anda dalam menyelesaikan soal fraksi mol tersebut.
Baca Juga :